Si el ADN es el libro de recetas de la vida, las proteínas son los chefs y las máquinas que ejecutan cada una de esas recetas. Son las que construyen, reparan y ponen en marcha prácticamente todo en nuestro cuerpo. Su función es tan crucial que el más mínimo cambio en su estructura puede marcar la diferencia entre la salud y la enfermedad.
En este punto es donde la biología se vuelve increíblemente compleja. Un solo gen no produce una única proteína, sino que puede generar múltiples variantes casi idénticas llamadas «proteoformas», cuyas pequeñas diferencias pueden marcar la frontera entre la salud y la enfermedad.
Estas variantes, como las de la familia de proteínas Tropomiosina (TPM), pueden tener funciones radicalmente diferentes, y sus alteraciones están vinculadas a enfermedades cardíacas como la miocardiopatía hipertrófica (MCH) y diversas afecciones del músculo esquelético. Sin embargo, distinguirlas es un desafío monumental para las herramientas científicas estándar; es como intentar diferenciar a dos gemelos idénticos basándose únicamente en su peso total.
Hasta ahora, distinguir estas variantes era casi imposible. Las técnicas tradicionales, como la espectrometría de masas, identifican proteínas por su peso, pero muchas difieren solo en un aminoácido o una modificación química —una diferencia tan sutil como el cambio de una letra en una palabra—.
Un reciente avance ha cambiado el panorama: la Secuenciación de Proteínas de Nueva Generación (NGPS) de la mano de Quantum-Si, implementada en un instrumento de sobremesa llamado Platinum, permite secuenciar proteínas individualmente, aminoácido por aminoácido. En lugar de pesar, esta tecnología “lee” cada aminoácido gracias a las interacciones de las moléculas reconocedoras con ellos, midiendo cuánto tiempo permanecen unidas: una firma cinética única para cada tipo.
Para demostrar sus capacidades, un estudio reciente de Sittipongpittaya N, y col. (Journal of Proteome Research; 2025; Protein Sequencing with Single Amino Acid Resolution Discerns Peptides That Discriminate Tropomyosin Proteoforms | Journal of Proteome Research) se centró en la compleja familia de proteínas TPM para poner a prueba la tecnología frente a tres desafíos fundamentales: distinguir proteínas de genes diferentes (parálogos), variantes del mismo gen (isoformas de splicing) y proteínas con modificaciones químicas (PTM).
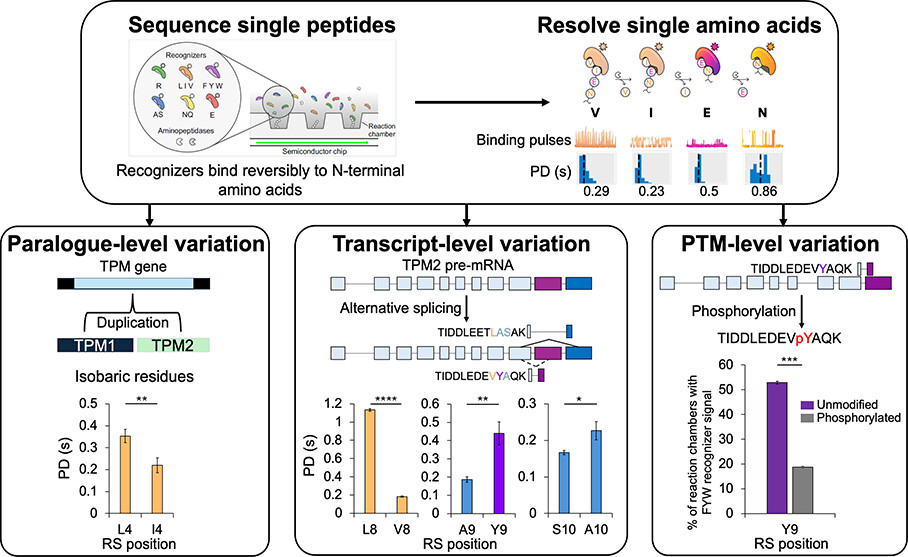
Revelación 1: Distinguir lo ‘indistinguible’: Gemelos de aminoácidos con el mismo peso
En el alfabeto de las proteínas, hay 20 letras o aminoácidos. Sin embargo, algunos son «gemelos isobáricos», lo que significa que tienen exactamente el mismo peso molecular. La leucina (Leu) y la isoleucina (Ile) son el ejemplo perfecto. Para métodos tradicionales como la espectrometría de masas, que se basan en el peso, estos dos aminoácidos son prácticamente indistinguibles.
La tecnología NGPS resuelve este enigma de una forma ingeniosa. En lugar de pesar los aminoácidos, utiliza «reconocedores» moleculares que se unen brevemente a ellos. La clave está en que la duración de esta interacción, o «duración del pulso» (PD), es única para cada aminoácido, creando una «firma cinética». El estudio demostró que el reconocedor, que tiene la mayor afinidad por la leucina, se une a ella durante un promedio de 0.35 segundos, mientras que a la isoleucina solo lo hace durante 0.23 segundos.
Gracias a esta diferencia, los investigadores pudieron distinguir con éxito dos péptidos de proteínas casi idénticas (TPM1 y TPM2) que solo se diferenciaban por una única sustitución:
- ENALDRAEQAEADK (de TPM1)
- ENAIDRAEQAEADK (de TPM2)
Esta capacidad abre la puerta a identificar con precisión variantes de proteínas implicadas en miopatías y cardiopatías hereditarias que hasta ahora eran difíciles de rastrear a nivel proteico.
Revelación 2: Desenmascarar a los ‘metamorfos’ moleculares: Variantes de una misma proteína
Un mismo gen puede ser editado de diferentes maneras dentro de nuestras células a través de un proceso llamado «splicing alternativo». El proceso sería similar a tener una receta maestra que se puede modificar ligeramente para crear un plato específico para cada ocasión. Este mecanismo permite que un solo gen produzca distintas isoformas de una proteína, a menudo específicas para diferentes tejidos.
El problema es que la presencia del ARN mensajero (la copia de la receta) no siempre garantiza que la proteína final se vaya a producir. De hecho, la inmensa mayoría de las proteoformas predichas aún no han sido validadas a nivel de péptido o proteína.
La tecnología NGPS permite confirmar qué variantes se están expresando realmente. En el estudio, ésta se utilizó para diferenciar péptidos de dos isoformas de TPM2 específicas de tejido:
- TIDDLEETLASAK
- TIDDLEDEVYAQK
Para ello, la tecnología no solo usó reconocedores distintos para aminoácidos diferentes (como Tirosina frente a Alanina), sino que también midió diferencias sutiles en la duración del pulso para distinguir aminoácidos estructuralmente similares. Por ejemplo, al comparar los aminoácidos en la novena posición de estas variantes —Leucina en una y Valina en la otra—, se detectó que el reconocedor se unía casi 9 veces más tiempo a la Leucina.
Revelación 3: Detectar los ‘interruptores’ químicos que activan o desactivan las proteínas
Una vez que se crea una proteína, su historia no ha terminado. A menudo, se le añaden pequeñas etiquetas químicas en un proceso llamado Modificación Post-Traduccional (PTM). Estas PTM actúan como interruptores que pueden encender, apagar o modificar drásticamente la función de una proteína. La fosforilación, o adición de un grupo fosfato, es uno de los «interruptores» más importantes.
El estudio investigó si la NGPS podía detectar este tipo de modificación. Para ello, compararon un péptido normal con su versión idéntica, pero con un grupo fosfato añadido a uno de sus aminoácidos, la tirosina:
- TIDDLEDEVYAQK (sin modificar)
- TIDDLEDEVpYAQK (fosforilado)
El resultado fue claro: la adición del grupo fosfato, que cambia significativamente la carga y la topología de la tirosina, debilitó la unión del reconocedor. Esto provocó una disminución drástica y medible en las señales de reconocimiento, demostrando que la tecnología es lo suficientemente sensible como para «ver» estos interruptores químicos a nivel de una sola molécula.
«Al secuenciar directamente péptidos individuales en un formato de sobremesa accesible, la NGPS tiene el potencial de superar algunas de las limitaciones de los métodos tradicionales, sirviendo como una herramienta ortogonal para el descubrimiento proteómico.»
Conclusión: Una nueva ventana al universo de las proteínas
La NGPS representa un salto comparable al que supuso la secuenciación del genoma, pero ahora centrado en los verdaderos actores funcionales: las proteínas. Su capacidad para distinguir variantes casi idénticas y modificaciones sutiles promete transformar la investigación biomédica, el descubrimiento de biomarcadores y la medicina de precisión.
Estas tres revelaciones obtenidas en el artículo de Sittipongpittaya y col.—distinguir aminoácidos isobáricos, identificar variantes de splicing y detectar modificaciones químicas— demuestran que estamos entrando en una nueva era de la proteómica. Al leer las proteínas molécula a molécula, la tecnología NGPS nos proporciona un nivel de detalle que antes era inalcanzable.
El hecho de que esta potente capacidad esté disponible en un instrumento de sobremesa la hace más accesible, prometiendo acelerar el descubrimiento en laboratorios de todo el mundo. Esta tecnología allana el camino para la detección selectiva de biomarcadores de proteoformas a nivel de una sola molécula. Y esto nos lleva a una pregunta apasionante: ahora que podemos ver estas sutiles pero cruciales diferencias entre proteínas con una claridad sin precedentes, ¿qué misterios biológicos estamos a punto de resolver?
Si quieres saber más sobre esta tecnología, no dudes en acceder a nuestra página web:
Platinum® y Platinum® Pro – Diagnóstica LongwoodReferencias:
Sittipongpittaya N, Skinner KA, Jeffery ED, Watts EF, Sheynkman GM. Protein Sequencing with Single Amino Acid Resolution Discerns Peptides That Discriminate Tropomyosin Proteoforms. J Proteome Res. 2025;24(8):3798-3807. doi:10.1021/acs.jproteome.4c00978
